中和の基本知識をチェック
「中和」とは、ある性質を持ったもの同士を混ぜ合わせたとき、それぞれの性質を打ち消し合う化学反応を指します。化学で用いられる、中和の基本知識を見ていきましょう。
「中和」の定義
中和とは、酸とアルカリ(塩基)を混ぜたときにそれぞれの性質が打ち消され合い、水と塩(えん)ができる化学反応を指します。
例えば、酸性の塩酸とアルカリ性(塩基性)の水酸化ナトリウム水溶液を混ぜ合わせると、お互い打ち消し合って水ができ、残りの物質は結合して「塩化ナトリウム」を生み出すのです。
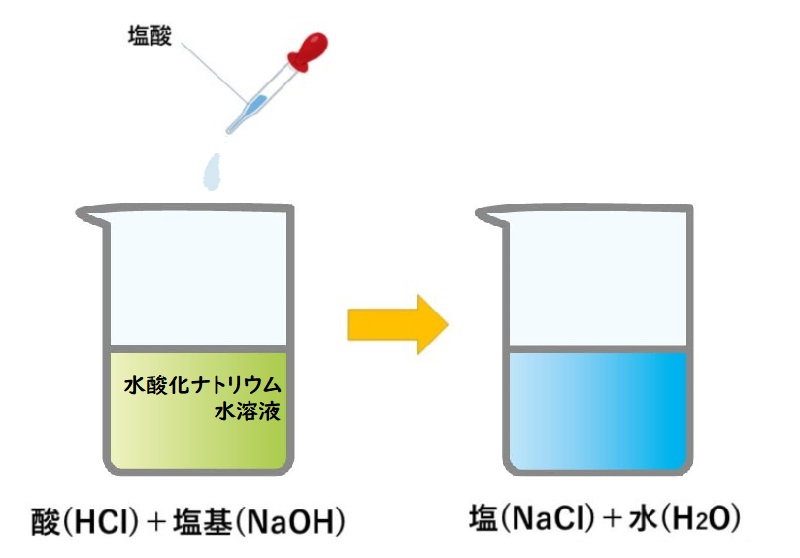
酸性の水溶液に含まれる水素イオン(H+)と、アルカリ性の水溶液に含まれる水酸化物イオン(OH-)が結びつくと、水が生成されます。
化学的に表すと「HCl(塩酸)+NaOH(水酸化ナトリウム) → NaCl(塩化ナトリウム)+H2O(水)」となります。
中和によって生成される「塩」とは何か
中和反応によって生まれる、水以外の物質を「塩(えん)」と呼びます。よく例に挙げられる塩酸と水酸化ナトリウム水溶液を混ぜたときにできるものが塩化ナトリウム、つまり一般的にいう塩(しお)なので誤解しがちですが、必ずしも食塩ができるとは限りません。
酸性やアルカリ性の物質には、さまざまなものがあります。混ぜ合わせるものによってどのような結びつきをするかが異なり、組み合わせによっては「塩化カルシウム」や「硫酸水素ナトリウム」などの塩ができることもあるのです。
酸性・アルカリ性・中性
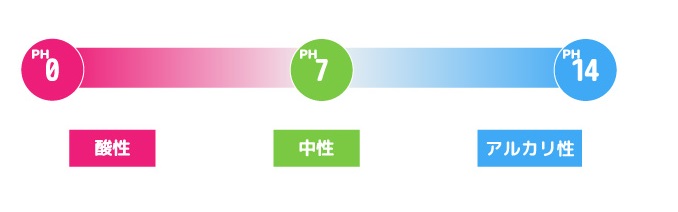
酸性・アルカリ性・中性は、水溶液の性質を示すときに使用する言葉です。中性は、どちらの性質でもないものを指します。
水溶液が酸性とアルカリ性のどちらなのかを調べるには、水溶液の中に含まれる「水素イオンの濃度」をチェックしましょう。水素イオンの濃度は「pH値」として表されます。pH値が「7」よりも大きければアルカリ性、小さければ酸性です。
化学の実験では、「リトマス試験紙」を使って見分ける方法が用いられます。水溶液にリトマス試験紙を浸し、赤くなれば酸性、青くなればアルカリ性、色に変化がなければ中性です。
また中和の実験には「BTB溶液」がよく使われます。BTB溶液は水溶液の性質を調べるときに使用する指示薬のことで、酸性なら黄色、中性なら緑、アルカリ性なら青に変化します。
▼関連記事はこちら

さまざまな物質を用いた中和実験
中和への理解をより深めるために、塩酸と水酸化ナトリウム水溶液以外を使用した中和実験の結果を見てみましょう。併せて、応用的な実験方法も紹介します。
硫酸と水酸化バリウム水溶液
硫酸は酸性、水酸化バリウムはアルカリ性の性質を持つ物質です。
二つの水溶液を混ぜ合わせたときの様子を化学式で表すと、「H2SO4(硫酸)+Ba(OH)2(水酸化バリウム) → 2H2O(水)+BaSO4(硫酸バリウム)」です。
硫酸は水素イオンと硫酸イオンに分かれ、水酸化バリウムはバリウムイオンと水酸化物イオンに分かれます。すると、水素イオンと水酸化物イオンが合わさって水ができ、残りの物質が結合して「硫酸バリウム」になるのです。
硫酸バリウムは塩化ナトリウムとは違い水に溶けにくいので、容器の底のほうに白い沈殿物ができます。

炭酸と水酸化カルシウム水溶液
炭酸は酸性、水酸化カルシウムはアルカリ性の性質を持ちます。
炭酸と水酸化カルシウム水溶液を混ぜ合わせたときの化学式は、「H2CO3(炭酸)+Ca(OH)2(水酸化カルシウム) → 2H2O(水)+CaCO3(炭酸カルシウム)」です。
炭酸カルシウムは水に溶けにくい性質を持つので、ビーカーの底に白い沈殿物がたまります。なお、水酸化カルシウム水溶液は石灰水のことで、学校で習う「石灰水に二酸化炭素を溶かすと白く濁る実験」がまさにこの実験です。授業で行った記憶がある人も多いでしょう。

中和の応用「中和滴定」
少し難易度が上がりますが「中和滴定(ちゅうわてきてい)」という、応用的な実験方法を一つ紹介します。
酸性もしくはアルカリ性の濃度が分からない液体に、濃度が判明している酸性もしくはアルカリ性の水溶液を使用することで、濃度を明らかにする方法のことです。
濃度の分からない水溶液をコニカルビーカーに入れて指示薬を加えたら、酸性あるいはアルカリ性の水溶液を滴下します。その滴下した体積をもとに計算し、濃度を探っていきます。中和滴定をするには、液体の体積を正確に測るためのビュレットや、吸い上げる液体の量を正確に測るホールピペットなどが必要です。
日常生活にある中和の身近な例
中和反応は化学の実験だけに用いられるわけではなく、家庭にある身近なものにもよく利用されています。どのようなものに利用されているのか、例を見ていきましょう。
トイレの消臭剤
嫌なにおいを打ち消すための消臭剤にも、中和反応が利用されています。
例えば市販のトイレの消臭剤には、においの原因であるアンモニア臭を打ち消すために、クエン酸が用いられることが少なくありません。アンモニアはアルカリ性のにおいなので、酸性のクエン酸やカテキンなどで打ち消せるのです。
他にも猫用のトイレ砂などにも、アルカリ性のにおいを中和するための酸性成分が配合されていることがあります。反対に、靴の消臭スプレーには、酸性のにおいを消すアルカリ性成分が使われているケースも見られます。身近にある消臭剤をチェックしてみましょう。

みかんの皮むきや魚のにおい取り
中和反応は食品の加工にも利用されており、例として缶詰用にみかんの薄皮をむく工程が挙げられます。
まず塩酸を使用して薄皮の大部分を溶かし、次に残りの薄皮を除去するために水酸化ナトリウムで処理します。これらの処理では、薄皮が効率的に除去できるだけでなく、塩酸の次に水酸化ナトリウムを使用することで成分が中和され、食品の安全性確保が可能となるのです。
魚の臭みを取る際にも中和反応が利用できます。魚の生臭さの原因の一つである「トリメチルアミン」はアルカリ性なので、レモンなどの柑橘類に含まれる有機酸によって打ち消すのです。
そのため柑橘類以外にも、酢・梅干し・トマトなどの酸性の食材は魚料理と相性がよいといえます。

さまざまに利用できる「中和」を理解しよう
酸性とアルカリ性の水溶液を混ぜ合わせたときに、水と塩(えん)ができる化学反応を中和と呼びます。中和の仕組みを知っていると消臭剤の選び方などに応用できたり、料理をおいしく食べたりするために活用できるでしょう。
化学の実験に使う薬品を、家庭で取り扱うのは危険な場合もあります。しかし、サンマにすだちを絞って食べてみるというように、身近な食べ物などを使って中和の実験をしてみると、子どもが化学に興味を持つきっかけになるかもしれません。
こちらの記事もおすすめ

構成・文/HugKum編集部





