陽イオン・陰イオンって何のこと?
イオンは原子の状態が変化したもので、変化の仕方によって陽イオンと陰イオンの2種類に分けられます。イオンの基本について、原子の構造も合わせて見ていきましょう。
イオンは原子が電気を帯びた状態のこと
イオンとは、中性の原子が、正(+)と負(-)どちらかの電気を帯びた状態のことです。正の電気を帯びると陽イオン、負の電気を帯びると陰イオンになります。
なお原子は、それ以上分けられない最小の物質です。身の回りにある全てのものは、さまざまな原子の組み合わせでできています。例えば水(H2O)は、二つの水素原子(H)と一つの酸素原子(O)が結合したものです。「水素」や「酸素」のように、原子の種類を表す言葉は「元素」といいます。
また、イオン化は一つの原子で起こることもあれば、複数の原子が結合した状態で起こることもあります。前者を単原子イオン、後者を多原子イオンと呼ぶことも覚えておきましょう。
原子が帯電する仕組み
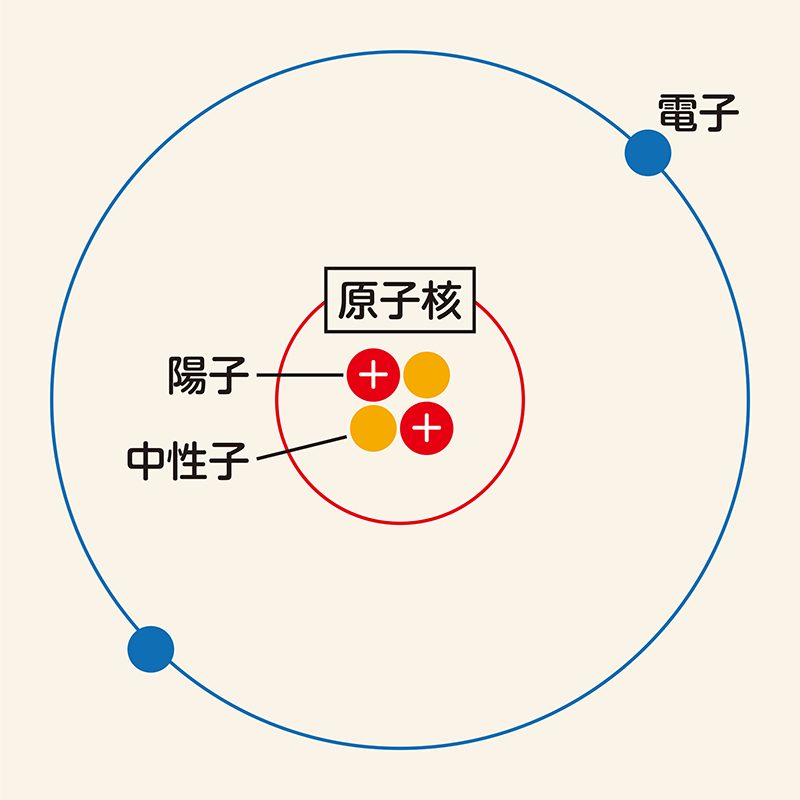
原子は、どのようにして電気を帯びるのでしょうか。原子は中性子と陽子および、陽子と同じ数の電子で構成されています。それぞれの性質は次の通りです。
●中性子:電気を帯びていない
●陽子:正の電気を帯びている
●電子:負の電気を帯びている
中性子と陽子は「原子核」の中に収まっており、電子は原子核の周りを飛びまわっています。また陽子の数は原子ごとに決まっていて、変わることはありません。
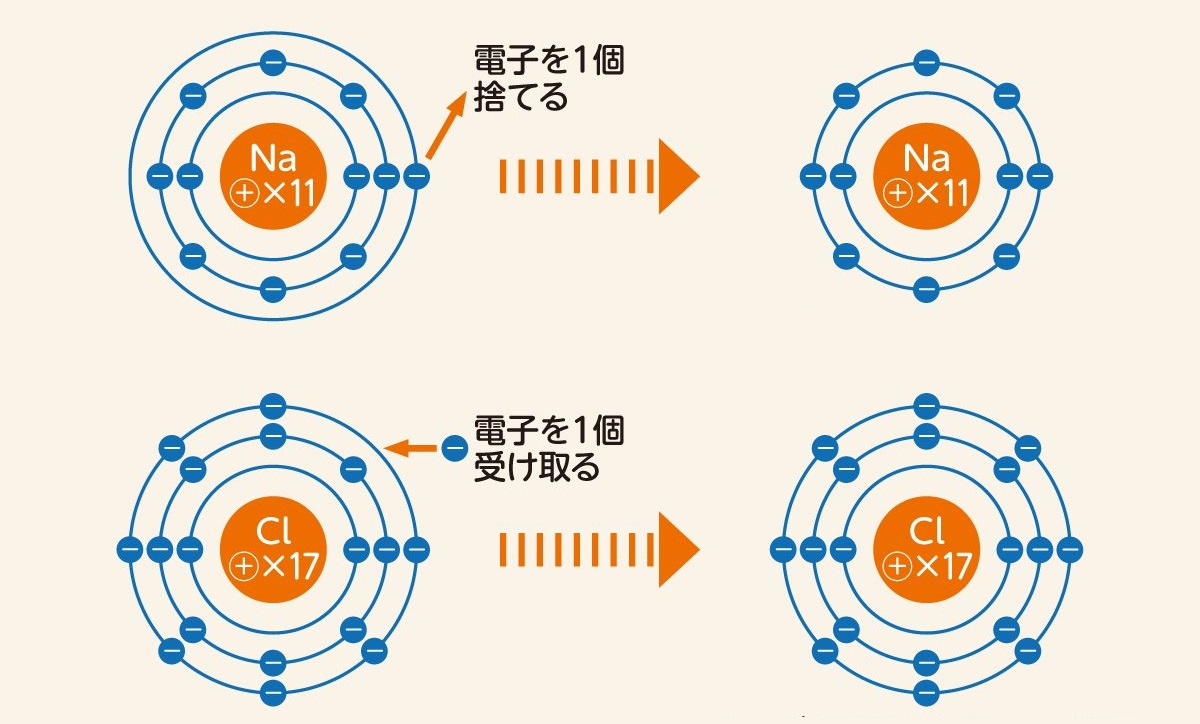
一方の電子は、何かのきっかけで数が増えたり減ったりします。電子数が一つでも増減すると、原子核の中にある陽子との数が合わなくなるため、原子全体が正または負の電気を帯びるようになります。
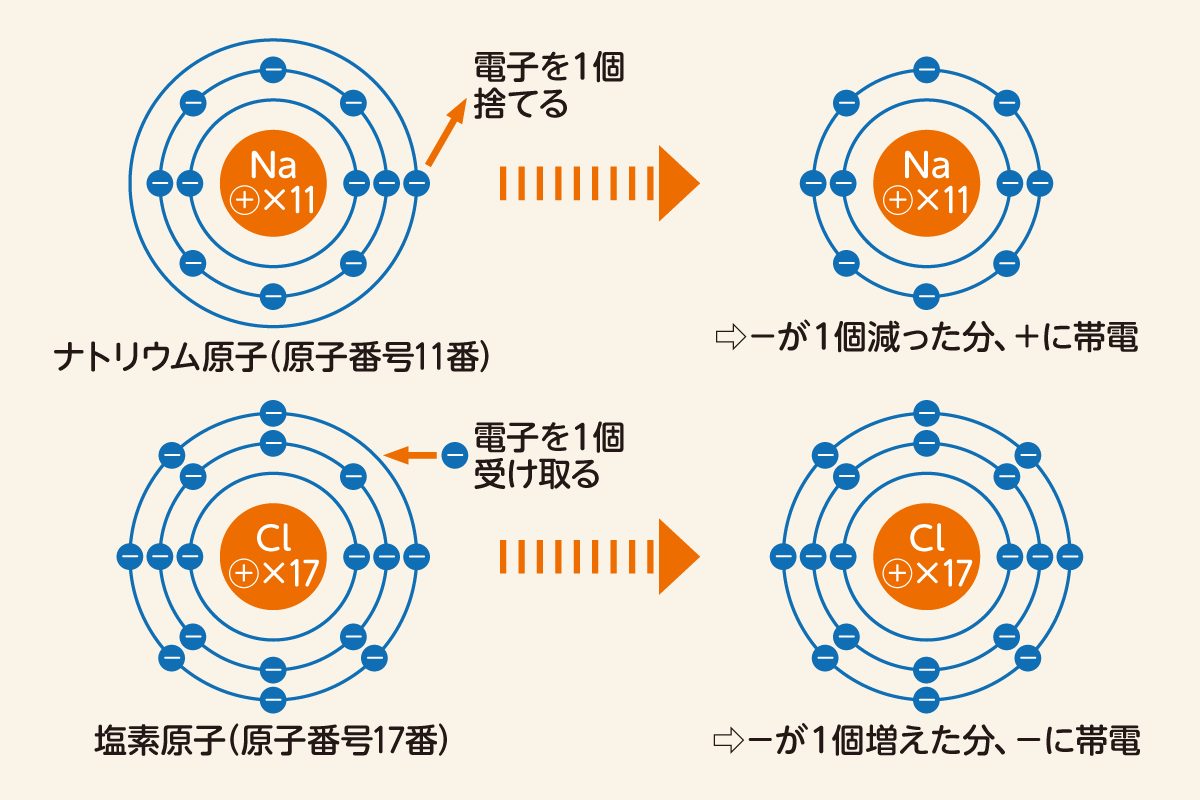
なお電気を帯びる前と後で、原子の性質自体は変わりません。原子の性質は陽子数によって決まり、電子の増減は無関係なためです。
▼「原子」「分子」についてはこちら
陽イオンと陰イオンの見分け方
原子の種類によって、正と負のどちらに帯電しやすい性質かが決まっています。例えば、水素は陽イオンになりやすい性質を持った原子です。
陽イオンと陰イオンをどのように見分ければよいのか、簡単な方法を二つ紹介します。
名前や化学式で見分ける
陽イオンと陰イオンは、名前や化学式が分かれば簡単に見分けられます。名前で見分ける方法は以下の通りです。
●元素名+イオン=陽イオン
●イオンの前に「化物」がついている=陰イオン
「水素イオン」や「ナトリウムイオン」のように、元素の名前の後にイオンがつく場合は、陽イオンです。陰イオンの多くは「塩化物イオン」のように、「〇〇化物イオン」と呼ばれます。ただし例外もあるので、注意が必要です。
また化学式では、Na+のように陽イオンは右上に「+」、陰イオンは「-」がつくと覚えておきましょう。
周期表で見当をつける
元素が周期表のどの場所にあるかによって、おおまかな見当をつけることも可能です。周期表は、元素を陽子の数が少ない順に並べたもので、元素記号の上の数字は陽子の数を表しています。
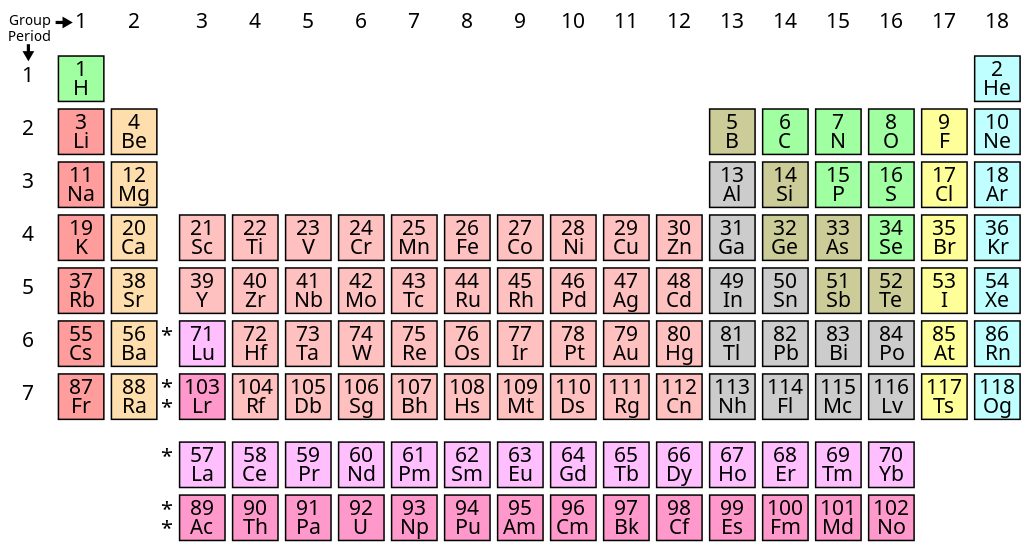
一番右側の列に配置されているのは、「貴ガス」と呼ばれる帯電しない元素です。貴ガス以外の元素には、電子の数を自分からもっとも近い貴ガスに合わせようとする性質があります。
例えば原子番号11のナトリウム(Na)は、もっとも近い原子番号10の貴ガス・ネオン(Ne)に合わせるため、電子を1個減らして陽イオンとなります。反対に原子番号17の塩素(Cl)は右隣の18・アルゴン(Ar)に合わせるため、電子を1個増やして陰イオンとなるのです。
覚えておきたい主なイオン
陽イオンと陰イオンには、代表的なものが存在します。それぞれの名前や化学式を覚えておくと、子どもの勉強を見てあげるときなどに役立つでしょう。
●陽イオン
H+(水素イオン)・K+(カリウムイオン)・NH4+(アンモニウムイオン)・Ca2+(カルシウムイオン)・Al3+(アルミニウムイオン)
●陰イオン
Cl-(塩化物イオン)・OH-(水酸化物イオン)・F-(フッ化物イオン)・NO3-(硝酸イオン)・S2-(硫化物イオン)
+や-の記号の前につく数字は「価数」といって、原子が電気を帯びるときに増減する電子数を表しています。例えば「Ca2+」の価数は2価で、カルシウムが電子を2個減らして陽イオンになったことを示しています。
陽イオン・陰イオンの豆知識
イオンは目に見えませんが、身の回りのさまざまな物事によって存在を感じとることは可能です。知っていると少しうれしい陽イオン・陰イオンの豆知識を紹介します。
もっとも身近なイオンの化合物「食塩」
陽イオンと陰イオンが互いに引きつけ合い、結合した物質を「イオン結晶」といいます。イオン結晶の中でも、特に身近な存在が食塩です。
食塩が、ナトリウムと塩素の化合物「塩化ナトリウム(NaCl)」であることを知っている人は多いでしょう。実は食塩は「ナトリウムイオン(Na+)」と「塩化物イオン(Cl-)」が結合したイオン結晶なのです。
イオン結晶は水に溶けると結合を解き、陽イオンと陰イオンに分かれます。つまり、食塩の水溶液の中には陽イオンと陰イオンが存在していると考えてよいでしょう。なお、水に溶けた後イオンに分離し、溶液中に存在する物質を「電解質」といいます。電解質には電気を通す性質があります。

スポーツドリンクや抗菌剤にも使われる
イオンは人の健康維持にも欠かせない存在です。人の体液には「ナトリウムイオン(Na+)」「カリウムイオン(K+)」「マグネシウムイオン(Mg2+)」などの電解質が多数含まれており、身体機能の維持に重要な役割を担っています。
もし一度に大量の汗をかいたり、長時間何も飲まずに過ごしたりして体内の水分量が減ると、電解質も不足して身体機能を維持できなくなります。
不足した電解質を補給する手段として有効なのが、スポーツドリンクです。スポーツドリンクには人体に必要な電解質がバランスよく含まれている上に、飲みやすい味になっているため、無理なく不足した電解質を補給できます。
また近年は日用品として、銀の除菌・殺菌力を生かした「銀イオン(Ag+)」配合の抗菌剤や消臭スプレーなども登場しています。
マイナスイオンは陰イオンの英語表記ではない
イオンの化学式には「+」「-」が使われることから、英語では「プラスイオン」「マイナスイオン」と呼ぶのだろうと考えている人もいるかもしれません。しかし実際の英語表記は、陽イオンが「cation(カチオン)」、陰イオンが「anion(アニオン)」です。
ドライヤーや空気清浄機などの家電の機能として語られる「マイナスイオン」も、化学の陰イオンとは全く違うものです。マイナスイオンの効果をうたった家電は一時期大変流行したこともあり、化学上の陰イオンと混同する人も多いので注意しましょう。

陽イオンと陰イオンを学んで化学を身近に
全ての物質の元となる原子は、化学を学ぶ上で避けては通れない存在です。原子が正または負の電気を帯びた状態を指すイオンにも、同じことがいえます。
子どもと一緒に、陽イオンと陰イオンの違いや見分け方などを知り、化学をより身近に感じてみましょう。
こちらの記事もおすすめ

構成・文/HugKum編集部