理科で習う電気分解とは?
電気分解は、中学校や高校の理科で習う分野です。学生時代の実験の記憶が残っている人も多いでしょう。まずは電気分解の定義をおさらいします。
電流によって起こる化学反応
電気分解は、「電解質溶液」に電流を流すことで起こる化学反応です。
電解質とは水に溶かすと「陽イオン」と「陰イオン」に分かれ、電気伝導性を持つようになる物質のことで、代表的な電解質は、塩化ナトリウム(食塩)・水酸化ナトリウム・塩化銅・硫酸などが挙げられます。
陽イオンはプラス、陰イオンはマイナスに、原子が電気を帯びた状態です。電解質溶液に電気を流すと、イオンはそれぞれ反対の電気を持つ電極に引き付けられ、そこで化学反応を起こすのです。
電気分解できない物質も
身の回りには、水に溶けても電解しない物質があります。そうした物質を「非電解質」といい、砂糖やアルコール、ベンゼンなどが代表的です。
アルコールが電解しない性質は、パソコンやスマートフォンなどの電子基板の洗浄に役立ちます。多くの電子部品が組み込まれている基板に、電解質を含む洗剤を使用すると、思わぬ場所に電気が流れて故障する可能性があります。
しかし「無水エタノール」のような純度の高いアルコールなら、電気を通さないため安心して使えるのです。
▼関連記事はこちら
電気分解の基礎知識
電気分解は、具体的にどのようにして起こすのでしょうか。使用する装置や化学反応の原理を見ていきましょう。
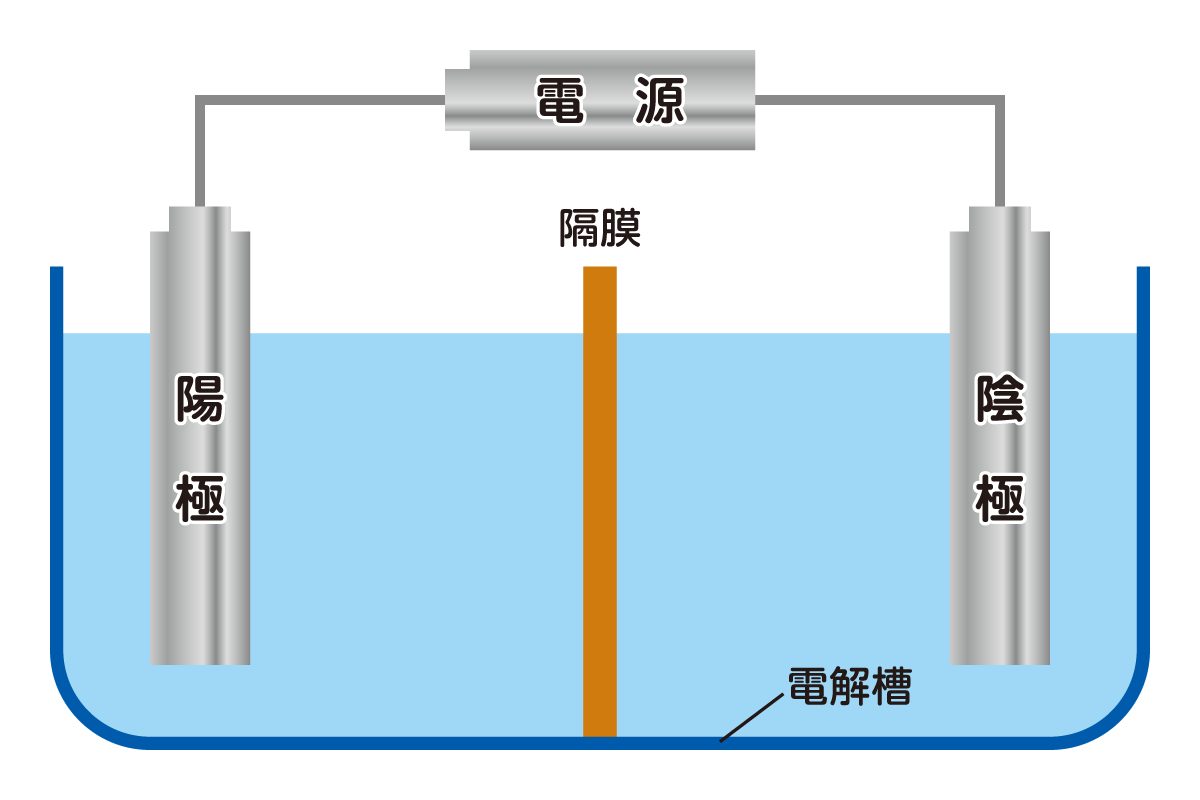
電気分解を起こす装置の仕組み
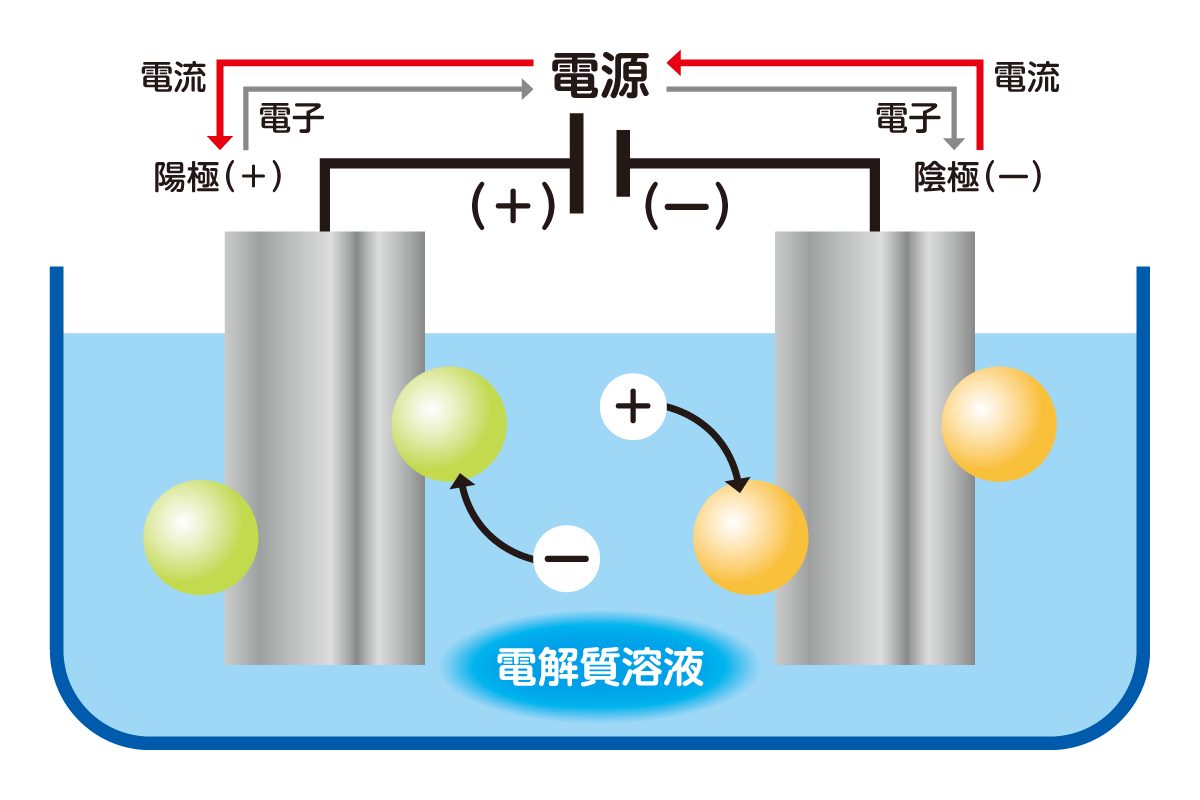
電気分解の装置は、下図のように一対の電極と、電源・電解槽で構成されます。電極には電気を通しやすく、かつ化学反応の影響を受けにくい「白金」や「黒鉛」を使用するのが一般的です。
電解質溶液を入れた電解槽に電極を差し込み、電気を流すと、電気分解が始まります。電源の負極側につなげた電極を「陰極」、正極側につなげたほうの電極を「陽極」と呼ぶことも覚えておくとよいでしょう。
「酸化還元反応」によって物質が分解される
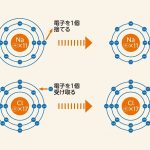
電解質溶液に電気を流すと、陽極側では「酸化反応」、陰極側では「還元反応」が起こります。酸化反応は物質が電子を手放すこと、還元反応は他の物質がその電子を受け取ることです。
先述の通り、電解質は水の中で陽イオンと陰イオンに分かれています。陰イオンが陽極に近付くと、電子を手放す酸化反応が起こります。放たれた電子は陽極を通って陰極に伝わり、陽イオンが受け取って還元反応が起こるのです。
酸化と還元は同時に起こるため、まとめて「酸化還元反応」と呼ばれます。この化学反応で物質が分解されることを、電気分解といいます。
水の電気分解を学ぼう
水の電気分解は中学校で実験することも多く、酸化還元反応を身近に感じるきっかけともいえます。水を電気分解すると、どうなるのか見ていきましょう。
水を電気分解してできるもの
水は「水素」と「酸素」の二つの原子から成る物質です。水素原子の「H」2個と、酸素原子の「O」1個が結びついて、一つの水分子「H2O」を構成しています。
その水を電気分解すると、陰極側に水素が、陽極側に酸素がそれぞれ気体となって発生します。水分子の構成から、発生する気体の体積比は水素:酸素=2:1となることも覚えておきましょう。
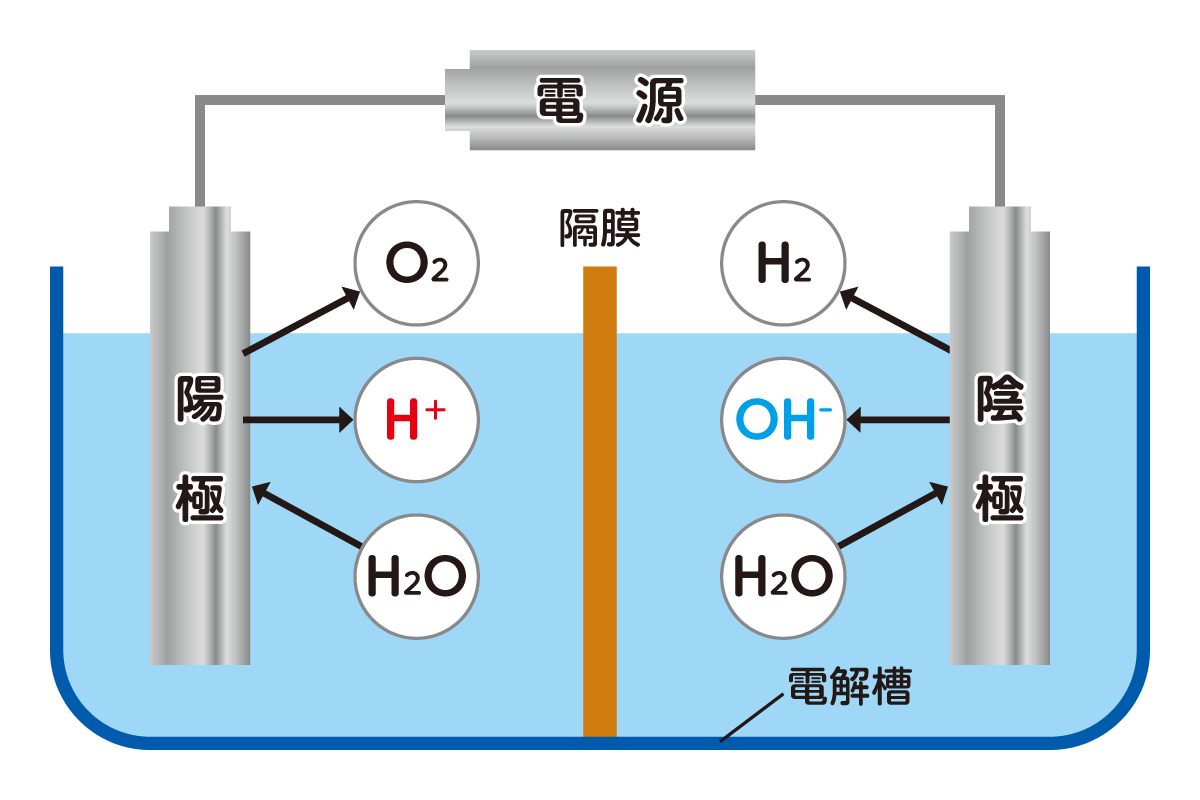
なお水素には「可燃性」、酸素にはものが燃えるのを助ける「助燃性」があり、この二つが混ざった気体に火を点けると、爆発が起こります。特に水素と酸素が2:1で混ざっている気体は反応が激しく、「爆鳴気(ばくめいき)」と呼ばれています。
水を電気分解する際のポイント
水はイオンに分かれにくく、そのままでは電気をあまり通しません。純度が高い水ほど、電気分解するには高い電圧をかける必要があります。
しかし水酸化ナトリウムなどの電解質を少量溶かせば、水の中にイオンが発生して電気が通りやすくなります。水酸化ナトリウムは水に溶けると、ナトリウムイオン(陽イオン)と水酸化物イオン(陰イオン)に分かれますが、電気分解の結果には影響しません。
ナトリウムイオンには、イオンのままでいるほうが安定する性質があるため、陰極側では水のほうが先に還元反応を起こし、水素ができるのです。このとき陽極側では水酸化物イオンが酸化反応を起こし、酸素が発生します。
電気分解の活用例
電気分解の仕組みは、さまざまな場所で使われています。電気分解の活用例を紹介します。
アルカリ電解水と酸性電解水
掃除用品売り場で、「アルカリ電解水」と目にした覚えがある人や、実際に使っている人は多いのではないでしょうか。アルカリ電解水とは、水を電気分解したときに陰極側の電解層で生成される水です。
タンパク質や油脂を分解する性質があり、キッチンやトイレ、浴室などさまざまな場所の掃除に使えます。界面活性剤で汚れを落とす洗剤とは異なり、すすぎや2度拭きが不要で、環境にも優しい点がメリットです。
一方、陽極側で作られる酸性電解水には殺菌作用があり、医療器具や食品の洗浄・消毒などに用いられています。ただし長期保存が難しく、家庭用として販売されることはほとんどありません。

海水の電解装置
海水を電気分解して、「次亜塩素酸ナトリウム」を作る装置も存在します。次亜塩素酸ナトリウムには強い殺菌作用があり、微生物や貝類が付着して、船底などが汚れるのを防ぐために使われます。
海水と電気のみで作れるため、他の方法よりも安価な上に、安定して運用できるのが特徴です。この装置は臨海の発電所や工場、船舶などに搭載されているほか、水族館の水質改善や上水道の殺菌など幅広く活用されています。
水素の生産
水素は次世代のクリーンエネルギーとして、注目されている物質です。しかし現状では、化石燃料を燃やしたガスから取り出す方法が主流で、水素を作るために多くの二酸化炭素を排出することへの矛盾が指摘されています。
水を電気分解して水素を発生させるのにも、発電に化石燃料を使っては無意味です。そこで近年は、太陽光や風力などの再生可能エネルギーで電気分解を行い、二酸化炭素を出さずに水素を生産できる製品や技術が続々と誕生しています。
水資源の枯渇に備え、海水を活用する方法も研究が進んでいます。海水から水素を取り出すと、どうしても陽極側で塩素ガスが出てしまうため、塩素の発生を抑える装置の実用化が期待されているのです。
電気分解の仕組みを理解し化学に親しもう
電気分解では、電解質が溶けたときに発生するイオンを利用して、化学反応を起こさせます。この仕組みを使えば、純度の高い水のように電気を通しにくい物質からも、水素や酸素を取り出せます。
この仕組みを理解することで、電気分解を使った製品を探してみるなど、子どもと一緒に化学の世界に親しんでみましょう。
こちらの記事もおすすめ

構成・文/HugKum編集部